Τι είναι τα ισότοπα;
- Συγγραφέας: Δημήτρης Μήλλας
- 18-10-2022
- Δυσκολία: Εύκολο
- Κατηγορίες: Αστροφυσική
Στον πυρήνα κάθε χημικού στοιχείου υπάρχουν δύο είδη υποατομικών σωματιδίων: τα πρωτόνια και τα νετρόνια. Ο αριθμός των πρωτονίων στον πυρήνα ενός στοιχείου ονομάζεται ατομικός αριθμός, ενώ το άθροισμα του αριθμού των πρωτονίων και των νετρονίων μαζικός αριθμός. Ιδιαίτερα σημαντικός είναι ο ατομικός αριθμός ενός στοιχείου, καθώς αυτός καθορίζει τις χημικές του ιδιότητες – στα μαθήματα χημείας συχνά αναφέρεται ως η «ταυτότητα» του στοιχείου.
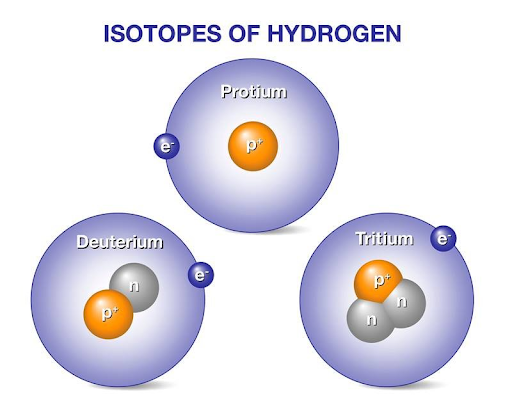
Στη φύση μπορούμε να βρούμε άτομα με τον ίδιο ατομικό, αλλά διαφορετικό μαζικό αριθμό. Τα άτομα αυτά ονομάζονται ισότοπα και σύμφωνα με τον ορισμό που δώσαμε παραπάνω, έχουν τον ίδιο αριθμό πρωτονίων και διαφορετικό αριθμό νετρονίων. Έτσι λοιπόν είναι άτομα του ιδίου στοιχείου, με σχεδόν τις ίδιες χημικές ιδιότητες. Χαρακτηριστικά παραδείγματα είναι τα ισότοπα του υδρογόνου: το πρώτιο (ένα πρωτόνιο και κανένα νετρόνιο στον πυρήνα του), το δευτέριο (ένα πρωτόνιο και ένα νετρόνιο) και το τρίτιο (ένα πρωτόνιο και δύο νετρόνια), εκ των οποίων τα δύο τελευταία είναι σημαντικά για την πυρηνική σύντηξη. Κάποια ισότοπα είναι ευσταθή ενώ άλλα είναι ραδιενεργά. Ο άνθρακας λ.χ., με ατομικό αριθμό 6, απαντάται σε τρία ισότοπα με μαζικό αριθμό 12,13 και 14 (δηλαδή με 6,7 και 8 νετρόνια αντίστοιχα στον πυρήνα). Τα πρώτα δύο είναι ευσταθή, ενώ το τρίτο είναι ραδιενεργό και χρησιμοποιείται ευρέως για τη χρονολόγηση μνημείων, δέντρων κ.α., μέσω της ραδιοχρονολόγησης.